4℃のナゾ
水は、他の物質にはない不思議な性質をたくさん持っています。ご質問にある体積が+4℃(厳密には、+3.98℃)で最小になる(言い換えると、密度が最大になる)というのもそのひとつです。この性質を持つ物質はとてもまれで、ほとんどすべての物質の液体は融点(結晶が融ける温度)の時に体積が最小で、温度が上がれば体積はだんだん大きくなっていきます。
この不思議な性質は、水が凍って氷の結晶になると水に浮かぶということとも関連しています。氷の結晶というのは、水分子が三次元に規則正しく並んだ構造をもっています。このとき隣り合った水分子どうしは、水素原子を介して結合しています。この結合を水素結合と呼びます。すなわち、氷の結晶とは水素結合の三次元的な組み合わせで出来ているとも言えるのですが、これがけっこう隙間の多い構造を作るのです。このため、水中の水分子がバラバラに配置した状態にあるときよりも、氷の結晶中の水分子間隔のほうが大きくなっています。すなわち、液体の水の状態よりも、体積は氷のほうが大きくなる(密度が小さくなる)ことになります。
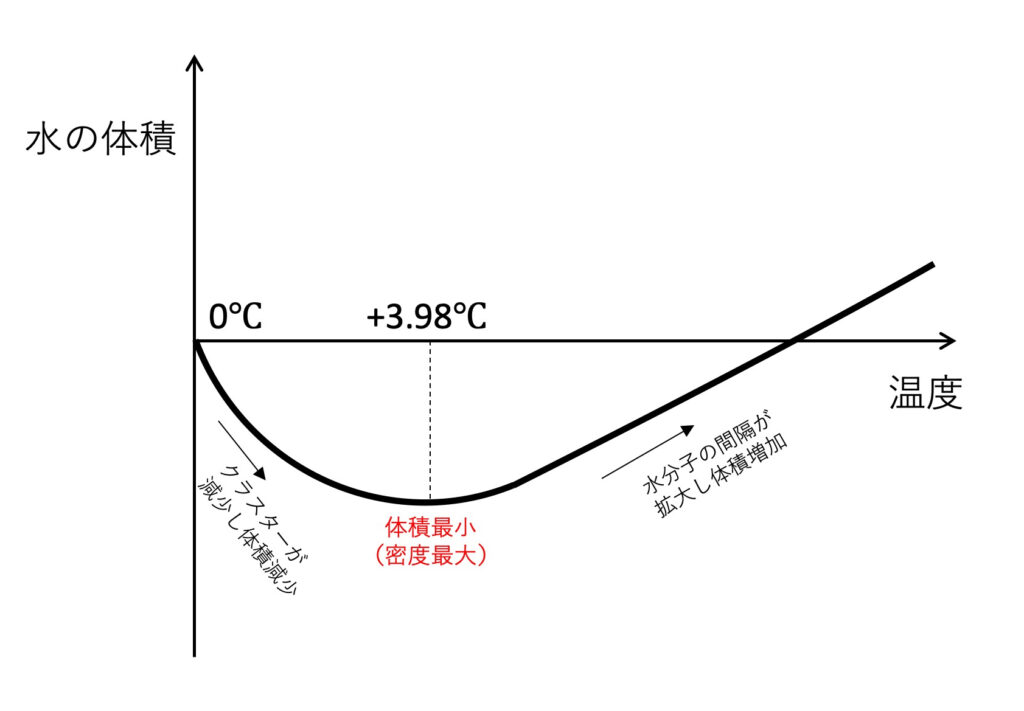
では、本題に戻りましょう。氷が溶けると液体の水に戻りますが、まだ0℃に近い温度では水の中の分子がすべてバラバラになっているわけではありません。すなわち、隣接する水分子どうしで水素結合を作っているものが、ごく一部ですが残っています。このような水分子のかたまりは、「クラスター」*と呼ばれます。このクラスターは、発生してもすぐに壊れてしまうのですが、水中のあちこちで発生していますので、全体として、常に一定の割合の水分子がクラスターになっています。この効果は、水全体の体積を増加させる(密度を減少させる)ことになりますが、温度が上昇するとクラスターも発生しにくくなりこの効果は弱まります。一方、さらに温度が上昇すると、水分子はより活発に動き回るようになりますので、分子間隔はだんだん拡大し、水全体の体積を増加させる(密度を減少させる)効果が働きます。この2つの効果が相殺するのがちょうど4℃という温度になります。このため、この温度で水の体積は最小(密度は最大)となるのです。(図を参照して下さい。)
他の多くの物質でも、それを溶かした液体の中では、水中と同じことが起きています。しかし、物質の固体(結晶)は、それが溶けた液体よりも体積が小さい(密度が大きい)のが普通ですので、融点の時に液体の体積が最小で温度が上昇すると体積は一方的に増えていきます。したがって、氷のこの性質はとても奇妙なのですが、シリコンなどごく一部の物質では同じ性質があることが知られています。これらの物質の結晶は、実は氷と同じような隙間の多い構造をとることも明らかになっています。
*「クラスター」という言葉は、コロナの蔓延が始まってから誰もが知るものになりましたが、もともとは「なにかの集団」という意味で、さまざまな分野で使われています。
(回答掲載日:2021年7月12日)

)
